BIOSPELÄOLOGIE
Höhlenfauna Malaysias
Helmut Steiner
Höhlenforschung war – und ist zum größten Teil noch – eine Domäne der westlichen Welt. Unser Bild von Höhlen ist daher vorwiegend von Höhlen der gemäßigten Breiten geprägt. Nirgends wird das deutlicher als bei der Biospeläologie. Blickt man nach Südostasien, so findet man eigentlich nur ein einziges Höhlensystem, das ökologisch als gut bearbeitet gelten kann, die Batu Caves bei Kuala Lumpur. Hier wurden schon vor mehr als 100 Jahren die ersten Aufsammlungen getätigt, und 1929 versuchte Dover erstmals, die Ökologie einer tropischen Höhle zu beschreiben (Yussof 1997).
Jedes Lebewesen benötigt Energie, und eine mögliche Betrachtungsweise der Ökologie ist es, den Energiefluß durch ein System darzustellen. Ökosysteme an der Oberfläche basieren bekanntermaßen auf der Sonnenenergie, mit deren Hilfe Pflanzen organische Materie aufbauen, die dann von anderen gefressen wird. Da Höhlen dunkel sind, fällt diese Quelle weg. Die Energie muß also auf andere Art und Weise eingebracht werden. Eine typische Höhle der gemäßigten Breiten ist ein extrem nährstoffarmes, d.h. energiearmes Habitat, das nur sehr wenige, spezialisierte Tiere unterhalten kann. Tropische Höhlen sind davon sehr verschieden. Sie unterhalten oft eine Fauna, die in ihrer Diversität Regenwaldhabitaten nicht nachsteht, und in ihren Abundanzen diese oft weit übertrifft (Yussof 1997).
Das tropische Höhlenökosystem per se ist ein Guano-System. Der Energieeintrag erfolgt fast ausschließlich durch Fledermäuse oder Vögel, die in den Höhlen nisten, aber zur Nahrungssuche ausfliegen. In gemäßigten Breiten suchen Fledermäuse Höhlen vor allem zum Winterschlaf auf. Hierbei nehmen sie keine Nahrung auf, der Stoffwechsel ist stark reduziert, der Energieeintrag in die Höhle daher minimal. Die Verhältnisse in tropischen Höhlen unterscheiden sich davon radikal, allein schon durch die schiere Masse der Tiere. Die größte Fledermauskolonie in Thailand wird auf 500.000 Tiere geschätzt (Miller et al. 1988). Schätzungen für die Deer Cave im Mulu National Park, Sarawak, schwanken zwischen 600.000 (Meredith et al. 1992) und 3-5 Millionen (Hall 1996). Die Vogelpopulation in den Niah Caves, Sarawak, die die berühmten eßbaren "Schwalbennester" bauen, aber keine Schwalben sondern Segler sind, werden von Medway (1962) auf über 4 Millionen geschätzt.
Die Faltenlippen-Fledermaus (Chaerephon plicata), die die Hauptmasse in Deer Cave stellt, hat einen täglichen Nahrungsbedarf von etwa 10g Insekten. Dies summiert sich beim geschätzten Minimum von 600.000 Tieren bereits zu 6 Tonnen, von denen ein Gutteil wieder als Guano ausgeschieden wird (Meredith et al. 1992). Der tägliche (!) Eintrag an organischem Material in tropische Höhlen reicht folglich in den Tonnenbereich herein. Fledermäuse wie auch Vögel sind als fliegende Tiere auf extreme Gewichtsreduzierung ausgerichtet. Beide können sich daher kein aufwendiges Verdauungssystem leisten. Sie entnehmen daher nur die am leichtesten zu verwertenden Nährstoffe, der Rest wird wieder ausgeschieden. Guano ist daher, mit anderen tierischen Exkrementen verglichen, noch relativ hochwertige Nahrung. Neben insektenfressenden Fledermäusen (und Seglern) nisten in tropischen Höhlen auch frucht- und nektarfressende Fledermäuse in großen Kolonien, vor allem die "Cave Fruit Bat" Eonycteris spelea. Früchte und Nektar haben vor allem einen sehr hohen Zuckergehalt, enthalten aber nur wenig Proteine. Um den Proteinbedarf zu decken, wird daher mehr Zucker aufgenommen, als verwertet werden kann. Guano der kleinen Flughunde gilt daher als nährstoffreicher als der von Insektenfressern. Daher beeinflußt neben der Menge auch die Zusammensetzung der Fledermausfauna die Guanogesellschaft am Boden. Für die Dark Cave sind 12 Arten von Fledermäusen beschrieben (Hall 1996), darunter zwei Flughundarten. Eine dritte Art wurde erst vor kurzem erstmals für die Dark Cave und für Malaysia berichtet (Kock et al. 2000). Schätzungen der Anzahl aller Fledermäuse belaufen sich auf bis zu einer Viertel Million (Yussof 1997), die Segler fehlen dafür in dieser Höhle. Auf diesen Fledermäusen basiert direkt oder indirekt eine Invertebratengemeinschaft, die McClure et al. (1967) mit 151 Arten aus 94 Familien beziffert. Einige neue Arten sind seither beschrieben worden, und weitere Neuentdeckungen sind nicht auszuschließen. Die Abbildungen 1 und 2 geben vereinfachte Nahrungsketten für zwei verschiedene Hallen der Dark Cave an, die sich durch Lichtintensität, Feuchtigkeitsschwankungen und demzufolge in ihrer Faunenzusammensetzung unterscheiden (McClure et al. 1967).
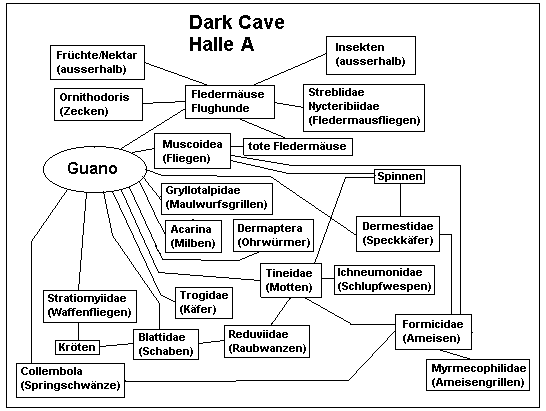
Abb. 1: vereinfachte Nahrungskette in Halle A
der Dark Cave, Batu Caves
(nach McClure et al. 1967, modifiziert).
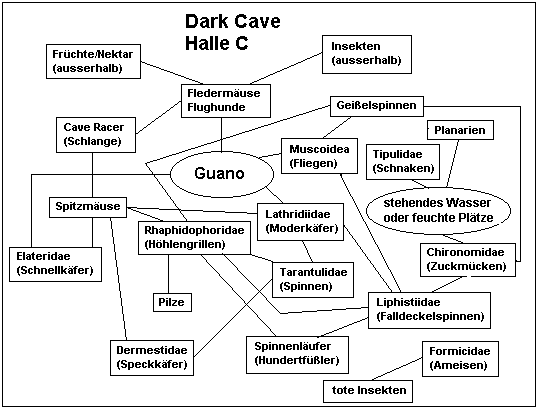
Abb. 2: vereinfachte Nahrungskette in Halle C
der Dark Cave, Batu Caves
(nach McClure et al. 1967, modifiziert).
Diese Nahrungsbeziehungen basieren vielfach auf dem, was allgemein über die jeweiligen Gruppen bekannt ist, auf Rückschlüsse von verwandten Arten oder auf Einzelbeobachtungen, die exakten Nahrungsbeziehungen sind oft noch unerforscht. Hier bietet sich ein weites Betätigungsfeld für Biospeläologen.
Collembolen, Milben, verschiedene Käfer, Larven von Motten und Fliegen sowie Schaben ernähren sich entweder direkt vom Guano oder vom darauf entstehenden Bakterien- und Pilzrasen (was sich meist schlecht unterscheiden läßt). Die Höhlengrillen weiden die Pilzfäden ab, die im Guano wachsen. Spinnen, Geißelspinnen, Hundertfüßler, Ameisen, Raubwanzen, Kröten und Spitzmäuse jagen die verschiedenen Guanofresser sowie die jeweils kleineren Räuber. Parasitische Wespen entwickeln sich in den Larven der Motten, andere Parasiten leben direkt an den Fledermäusen. Tote Fledermäuse sowie andere, in der Höhle verendenden Tiere stellen eine weitere Nahrungsquelle dar. Selbst lebende Fledermäuse werden vom Cave Racer gejagt, einer höhlenbewohnenden Schlange, die hervorragend klettert (und damit bewirkt, daß sich die Fledermäuse in der Mitte der hohen Hallen konzentrieren, wo sie außer Reichweite der Schlangen, aber auch der Biologen sind).
Die Zahlenverhältnisse der einzelnen Arten unterliegen starken Schwankungen übers Jahr, bedingt durch Schwankungen in der Feuchtigkeit (Regenzeit!), Brutzyklen der Fledermäuse, jahreszeitlichen Schwankungen in deren Nahrungsangebot und damit verbundener unterschiedlicher Sterblichkeit, die sich in der ein- oder anderen Form auf das Nahrungsangebot der anderen Arten auswirken. Weiterhin ergeben sich selbst in den permanent dunklen Teilen der Höhle Tagesrhythmen, die durch die An- oder Abwesenheit der Fledermäuse definiert sind (McClure et al. 1967).
Besondere Erwähnung verdient noch die Falldeckelspinne Liphistius batuensis, die nach dieser Höhle benannt ist und nur hier vorkommt (ein zweites Vorkommen in der einige Kilometer entfernten Gua Anak Takun ist wahrscheinlich erloschen). Diese Spinne baut mit Erde getarnte Seidennester an die Höhlenwände, die an der Vorderseite mit einer Falltür versehen sind. Von deren Rahmen gehen sternförmig acht Signalfäden aus, die der Spinne die Annäherung von möglicher Beute oder Feinden verrät. Erstere wird blitzschnell gepackt und in das Nest gezogen, bei letzterer wird die Falltür fest verschlossen. So faszinierend dieses Jagdverhalten ist, die eigentliche Besonderheit ist eine andere: Liphistius besitzt neben einigen anderen Eigenschaften einen segmentierten Hinterleib und acht Spinnwarzen, Merkmale, die nur von fossilen Spinnen aus dem Karbon bekannt sind und die alle anderen Spinnen nicht mehr aufweisen. Die Gattung Liphistius gilt daher als lebendes Fossil. Weitere arten dieser Gattung leben in Lehmwänden an Flußufern und Hanganschnitten durch Straßen, zwei weitere Höhlenarten wurden jedoch in Perak, 300 km nördlich der Batu Caves gefunden (Steiner 1998).
Zusammenfassend läßt sich sagen, daß tropische Höhlen eine außerordentlich
zahl- und artenreiche, hochinteressante Fauna beherbergen, die eine direkt oder
indirekt mit Guano assoziierte Gesellschaft bildet. Durch die von gemäßigten
Breiten geprägte Sichtweise wird den Guanobiern oft der Status als Troglobiont
oder echtes Höhlentier abgesprochen, da sie nur selten die
"typischen" Merkmale wie lange Körperanhänge sowie Augen- und
Farblosigkeit aufweisen, oder zumindest ein gewisses Desinteresse
entgegengebracht. Es sollte jedoch bedacht werden, daß derart massive
Guanoansammlungen – es wurden schon Schichtdicken bis 12m festgestellt! –
und die damit assoziierten Gesellschaften außerhalb von Höhlen nicht
existieren. Sie stellen damit ein typisches Höhlenhabitat und eine typische Höhlengesellschaft
dar, und alle daran beteiligten Arten, die außerhalb der Höhlen nicht
vorkommen, sollten als echte Troglobionten betrachtet werden.
Literaturverzeichnis:
Kock, D., Altmann, J. & Price, L. 2000: A Fruit Bat new to West Malaysia: Rousettus leschenaultii (Desmarest 1820) in Batu Caves. Malayan Nature Journal 54 (1): 63-67.
McClure, H.E., Lim, B.-L. & Winn, S.E. 1967: Fauna of the Dark Cave, Batu Caves, Kuala Lumpur, Malaysia. Pacific Insects 9 (3): 399-428.
Hall, L. 1996: Observations on bats in Gua Payau (Deer Cave), Gunung Mulu National Park, Sarawak. Sarawak Museum Journal 71: 111-124.
Medway, Lord 1962: The Swiftlets (Collocalia) of Niah Cave, Sarawak. Part 2. Ecology and the regulation of breeding. Ibis 104: 228-245.
Meredith, M., Woolridge, J. & Lyon, B. 1992: Giant Caves of Borneo. Tropical Press, Kuala Lumpur.
Miller, L.A., Mohl, B., Brockelman, W.Y., Andersen, B.B., Christensen-Dalsgaard, J., Jorgensen, M.B. & Surlykke, A. 1988: Fly-out count of the bat, Tadarida plicata, using a video recording. Natural History Bulletin of the Siam Society 36: 135-141.
Steiner, H. 1998: Lebende Fossilien aus den Höhlen Malaysias. Mitteilungen des Verbandes deutscher Höhlen- und Karstforscher 44 (4): 148-150.
Yussof, S. 1997: The natural and other histories of Batu Caves. Malaysian Nature Society, Kuala Lumpur.